25
2023
-
09
體外診斷試劑申報資料說明書/標簽的提交要求
分類:
行業新聞
國家在持續加強對醫療器械的注冊管理,對我們申請人所提交的材料要求是“材料齊全、符合法定形式要求的”。那今天,我們和大家來談談體外診斷試劑申報資料中的說明書/標簽材料的提交要求。
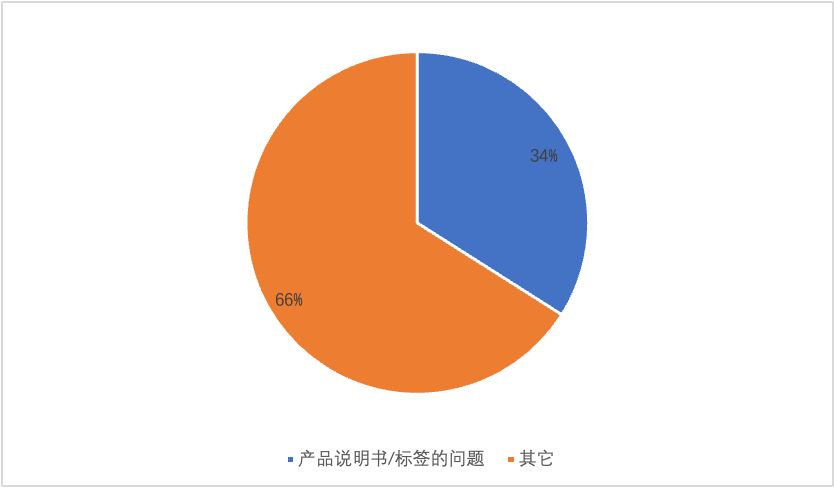
根據福建省公布的2019-2021年間,對第二類體外診斷試劑產品首次注冊申報資料的缺陷項目統計中,產品說明書/標簽的問題占比34%,占據缺陷項目統計中的首位。
1. 體外診斷試劑說明書:
在2021年9月,國家藥監局發布的《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》的附件4《體外診斷試劑注冊申報資料要求及說明》中,關于產品說明書和標簽樣稿的要求如下:

根據要求,體外診斷試劑的產品說明書,需要符合《體外診斷試劑說明書編寫指導原則》,現行的指導原則是2014年版,在該指導原則對體外診斷試劑產品說明書編寫的格式及各項內容的撰寫進行了詳細的說明,為我們編寫體外診斷試劑產品說明書提供了原則性指導和參考。

其中,體外診斷試劑說明書格式要求如下:
××××(產品通用名稱)說明書
【產品名稱】
【包裝規格】
【預期用途】
【檢驗原理】
【主要組成成分】
【儲存條件及有效期】
【適用儀器】
【樣本要求】
【檢驗方法】
【陽性判斷值或者參考區間】
【檢驗結果的解釋】
【檢驗方法的局限性】
【產品性能指標】
【注意事項】
【參考文獻】
【注冊人】(或者【備案人】)
【醫療器械注冊證編號】(或者【醫療器械備案憑證編號】)
【生產企業】
【醫療器械生產企業許可證編號】(或者【醫療器械生產備案憑證編號】)
【說明書批準及修改日期】
2.標簽:
標簽樣稿的內容應當符合《醫療器械說明書和標簽管理規定》,當前實施的版本是2014年7月國家藥監局發布的:

《醫療器械說明書和標簽管理規定》中第十三條,對標簽中應包含的一般內容進行了詳細規定,并在最后提到:“醫療器械標簽因位置或者大小受限而無法全部標明上述內容的,至少應當標注產品名稱、型號、規格、生產日期和使用期限或者失效日期,并在標簽中明確‘其他內容詳見說明書’。“
同時在《醫療器械說明書和標簽管理規定》中第十四條中,對產品說明書和標簽不得有的內容,進行了詳細說明:

上一篇
相關新聞



